全国艾滋病检测技术规范
更新时间:2006/6/26 12:47:20 点击数:
目 录
第一章 样品的采集和处理……………………………………………………………………1
1 范围………………………………………………………………………………………1
2 规范性引用文件…………………………………………………………………………1
3 操作步骤…………………………………………………………………………………1
3.1 样品的采集和处理…………………………………………………………………1
3.2 样品的保存…………………………………………………………………………1
3.3 样品的运送…………………………………………………………………………2
3.4 样品的接收…………………………………………………………………………2
第二章 HIV抗体检测………………………………………………………………………………3
1 范围………………………………………………………………………………………3
2 规范性引用文件…………………………………………………………………………3
3 HIV抗体检测实验室………………………………………………………………………3
4 HIV抗体检测的目的和要点…………………………………………………………3
4.1 HIV抗体检测的目的…………………………………………………………………3
4.2 HIV抗体检测的要点…………………………………………………………………3
5 常规HIV抗体检测的方法和程序…………………………………………………………4
5.1 HIV抗体检测筛查试验………………………………………………………………4
5.2 HIV抗体确认试验……………………………………………………………………6
6 HIV抗体检测的替代策略…………………………………………………………………8
6.1 替代策略Ⅰ…………………………………………………………………………9
6.2 替代策略Ⅱ…………………………………………………………………………10
6.3 替代策略Ⅲ…………………………………………………………………………11
7 HIV抗体检测情况季报的时间和程序……………………………………………………12
第三章 HIV核酸定性检测…………………………………………………………………………13
1 范围………………………………………………………………………………………13
2 规范性引用文件…………………………………………………………………………13
3 实验室条件………………………………………………………………………………13
3.1 实验室功能分区……………………………………………………………………13
3.2 人员………………………………………………………………………………14
3.3 设施和设备………………………………………………………………………14
4 方法和试剂………………………………………………………………………………14
4.1 方法………………………………………………………………………………14
4.2 试剂………………………………………………………………………………14
5 扩增目的基因片段………………………………………………………………………15
5.1 样品的采集和处理…………………………………………………………………15
5.2 核酸提取……………………………………………………………………………15
5.3 逆转录………………………………………………………………………………15
5.4 PCR扩增……………………………………………………………………………15
6 扩增产物分析及结果报告………………………………………………………………15
6.1 常用的扩增产物分析………………………………………………………………15
6.2 结果判定和报告……………………………………………………………………15
7 实验室管理…………………………………………………………………………………15
7.1 生物安全……………………………………………………………………………16
7.2 严格执行分区制度…………………………………………………………………16
7.3 仪器和材料的专用制度……………………………………………………………16
7.4 单向流向制度……………………………………………………………………16
7.5 废弃物处理制度……………………………………………………………………16
第四章 HIV RNA定量测定(病毒载量测定)………………………………………………17
1 范围…………………………………………………………………………………………17
2 规范性引用文件……………………………………………………………………………17
3 实验室条件…………………………………………………………………………………17
3.1 实验室功能分区……………………………………………………………………17
3.2 人员…………………………………………………………………………………18
3.3 设施和设备…………………………………………………………………………18
4 方法和试剂…………………………………………………………………………………18
4.1 方法…………………………………………………………………………………18
4.2 试剂…………………………………………………………………………………19
5 实验室管理…………………………………………………………………………………19
5.1 生物安全……………………………………………………………………………19
5.2 严格执行分区制度…………………………………………………………………19
5.3 仪器和材料的专用制度……………………………………………………………19
5.4 单向流向制度………………………………………………………………………19
5.5 废弃物处理制度……………………………………………………………………20
5.6 质量控制和评价……………………………………………………………………20
6 HIV核酸定量检测的意义……………………………………………………………20
6.1 辅助诊断…………………………………………………………………………20
6.2 早期诊断…………………………………………………………………………20
6.3 病程监控…………………………………………………………………………20
6.4 指导治疗方案及疗效判定………………………………………………………21
6.5 预测疾病进程……………………………………………………………………21
第五章 CD4+和CD8+T淋巴细胞检测……………………………………………………………22
1 范围………………………………………………………………………………………22
2 规范性引用文件………………………………………………………………………22
3 实验室条件……………………………………………………………………………22
3.1 人员…………………………………………………………………………………22
3.2 设施和设备…………………………………………………………………………22
3.3 功能分区………………………………………………………………………22
4 样品采集、运输和接收…………………………………………………………………22
4.1 样品的采集…………………………………………………………………………22
4.2 样品运输……………………………………………………………………………23
4.3 样品接收……………………………………………………………………………23
5 方法………………………………………………………………………………………23
6 实验资料的记录…………………………………………………………………………23
7 结果报告…………………………………………………………………………………24
8 质量控制和评价………………………………………………………………………25
9 检测CD4+、CD8+ T淋巴细胞的意义…………………………………………………25
第六章 HIV抗原检测……………………………………………………………………………26
1 范围………………………………………………………………………………………26
2 规范性引用文件…………………………………………………………………………26
3 实验条件…………………………………………………………………………………26
3.1 人员…………………………………………………………………………………26
3.2 设施和设备…………………………………………………………………………26
3.3 防护用具……………………………………………………………………………26
3.4 实验材料……………………………………………………………………………26
4 抗原检测………………………………………………………………………………26
4.1 适用范围……………………………………………………………………………26
4.2 试剂…………………………………………………………………………………26
5 HIV P24抗原检测方法……………………………………………………………………27
5.1 试验准备……………………………………………………………………………27
5.2 试验操作……………………………………………………………………………27
5.3 试验结果……………………………………………………………………………27
5.4 结果报告和解释……………………………………………………………………27
第七章 艾滋病实验室安全防护和职业暴露预防……………………………………………29
1 范围………………………………………………………………………………………29
2 规范性引用文件…………………………………………………………………………29
3 实验室生物安全级别……………………………………………………………………29
3.1 艾滋病血清学检测…………………………………………………………………29
3.2 HIV分离、研究……………………………………………………………………29
4 实验室安全防护…………………………………………………………………………29
4.1 个人防护及保健……………………………………………………………………29
4.2 实验室管理要求……………………………………………………………………30
4.3 实验室的安全操作…………………………………………………………………31
4.4 避免利器的使用……………………………………………………………………32
4.5 样品的采集…………………………………………………………………………32
4.6 带入和带出实验室的物品…………………………………………………………32
5 废弃物处置和消毒………………………………………………………………………33
5.1 废弃物处置…………………………………………………………………………33
5.2 HIV常用的消毒方法………………………………………………………………33
6 实验室意外和事故处理…………………………………………………………………33
6.1 意外和事故…………………………………………………………………………33
6.2 意外和事故的紧急处理措施………………………………………………………33
6.3 意外和事故登记、报告和检测……………………………………………………34
7 艾滋病的职业暴露后预防………………………………………………………………34
7.1 职业暴露……………………………………………………………………………34
7.2 HIV/AIDS的职业暴露后预防………………………………………………………34
8 安全药品储备点的建立及管理机制……………………………………………37
第八章 艾滋病实验室质量管理……………………………………………………………………39
1 范围………………………………………………………………………………………39
2 规范性引用文件…………………………………………………………………………39
3 质量保证(QA)…………………………………………………………………………39
3.1 行政支持……………………………………………………………………………39
3.2 实验室规范化建设…………………………………………………………………39
3.3 人员培训及其评价…………………………………………………………………39
3.4 标本采集、运送和处理……………………………………………………………39
3.5 检测方法和试剂的选择……………………………………………………………39
3.6 设备维护与校准……………………………………………………………………39
3.7 文件和文件管理……………………………………………………………………40
4 质量控制(QC)…………………………………………………………………………41
4.1 质控血清的制备和保存……………………………………………………………41
4.2 质控图的建立及应用………………………………………………………………42
4.3 “即刻法”质控……………………………………………………………………44
5 质量评价(EQA)…………………………………………………………………………45
5.1 评价体系……………………………………………………………………………45
5.2 实验室室间质量评价及质量考评…………………………………………………45
第九章 艾滋病实验室质量考评办法…………………………………………………………46
1 范围………………………………………………………………………………………46
2 规范性引用文件…………………………………………………………………………46
3 考评目的…………………………………………………………………………………46
4 考评对象及组织单位……………………………………………………………………46
5 考评内容和方式…………………………………………………………………………46
6 考评工作程序……………………………………………………………………………47
7 考评结果的判定…………………………………………………………………………48
7.1 判分原则……………………………………………………………………………48
7.2 常规评分标准………………………………………………………………………48
7.3 考评结果的判定……………………………………………………………………48
8 考评结果的处理…………………………………………………………………………49
8.1 对考评合格实验室的资格认证和鼓励……………………………………………49
8.2 对考评成绩较差实验室的整顿措施…………………………………………………49
8.3 各参评实验室考评资料汇总及存档…………………………………………………49
第十章 HIV诊断试剂临床质量评估方案………………………………………………………50
1 范围………………………………………………………………………………………50
2 规范性引用文件…………………………………………………………………………50
3 评估目的…………………………………………………………………………………50
4 评估组织及参加单位……………………………………………………………………50
4.1 国家级评估…………………………………………………………………………50
4.2 省级评估……………………………………………………………………………50
5 评估程序…………………………………………………………………………………50
5.1 国家级评估…………………………………………………………………………50
5.2 省级评估……………………………………………………………………………51
6 评估结果的分析及统计处理……………………………………………………………51
7 评估结果的收集、分析、上报和反馈…………………………………………………52
附表1 HIV抗体筛查报告…………………………………………………………………53
附表2 HIV抗体复检化验单………………………………………………………………54
附表3 HIV抗体确认检测报告单…………………………………………………………55
附表4 HIV感染流行病学监测疫情报告单………………………………………………56
附表5 HIV抗体替代策略检测报告单 …………………………………………………57
附表6 HIV抗体检测数季报表…………………………………………………………58
附表7 艾滋病职业暴露个案登记表………………………………………………………59
附表8 艾滋病防治工作人员职业暴露事故汇总表………………………………………62
第一章 样品的采集和处理
1 范围
本章规定了用于艾滋病病毒(HIV)检测的血清、血浆和全血样品的采集和处理方法,适用于HIV抗体检测、抗原检测、核酸检测、CD4+/CD8+T淋巴细胞测定和HIV分离培养。
2 规范性引用文件
Guidelines for Using HIV Testing Technologies in Surveillance WHO/CDS/CSR/EDC/2001.16 UNAIDS/01.22E ISBN 9713-92-063-7.
3 操作步骤
3.1 样品的采集和处理
艾滋病检测最常用的样品是血液,包括血清、血浆和全血。唾液或尿液有时也可作为测试样品。常用的血液样品的采集和处理方法如下:
3.2 样品的保存
3.3 样品的运送
3.4 样品的接收
样品处理时若内容物有可能溅出,则应在生物安全柜中戴手套进行。同时应戴口罩、防护眼镜,以防皮肤或粘膜污染。
第二章 HIV抗体检测
1 范围
本章规定了HIV抗体的检测方法、检测程序、检测报告及检测策略,适用于各级各类医疗机构、疾病预防控制机构、检验检疫机构、采供血机构及卫生保健机构。可作为对HIV感染者/AIDS病人的诊断、报告和处理的实验室依据。
2 规范性引用文件
Revised recommendations for the selection and use of HIV antibody tests. WHO/UNAIDS Revised version 2001.
实验室生物安全通用要求(GB 19489-2004)。
3 HIV抗体检测实验室
应符合《全国艾滋病检测工作规范(1997年版)》中对检测实验室人员、建筑设施和设备等条件的要求。
应符合《实验室 生物安全通用要求》(GB 19489-2004)对II级生物安全实验室(BSL-2)的各项要求。
实验室的质量保证按本规范第八章规定执行。
实验室安全防护按本规范第七章规定执行。
4 HIV抗体检测的目的和要点
4.1 HIV抗体检测的目的
4.2 HIV抗体检测的要点
5 常规HIV抗体检测的方法和程序
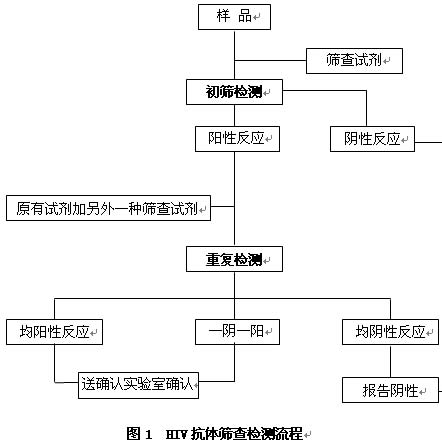
HIV抗体检测分为筛查试验(包括初筛和复检)和确认试验。
5.1 HIV抗体检测筛查试验
必须是经国家食品药品监督管理局注册批准、批批检合格、在有效期内的试剂。推荐使用经临床质量评估敏感性和特异性高的试剂。
目前国内外主要使用第三代(双抗原夹心法)试剂,少数使用第二代试剂。血源筛查仍以第三代ELISA为主,国际上有些国家和地区已将线性免疫酶测定(第四代ELISA试剂)用于血源筛查。第四代ELISA试剂是最近发展起来的HIV抗原抗体联合测定试剂,可同时检测P24抗原和抗HIV-1/2抗体。与第三代抗HIV-1/2试剂相比,检出时间提前了4~9.1d。其优点在于能同时检测抗原抗体,降低血源筛查的残余危险度。
随着对HIV感染者和AIDS病人抗逆转录病毒治疗的进展,及对无症状HIV感染者提供自愿咨询检测(VCT)的迫切需求,简便、快速的HIV检测方法被广泛应用。常用的主要有以下几种:
(1)明胶颗粒凝集试验(PA):PA是HIV血清抗体检测的一种简便方法,是将HIV抗原致敏明胶颗粒作为载体,与待检样品作用,混匀后保温(一般为室温)。当待检样品含有HIV抗体时,经抗原致敏的明胶颗粒与抗体发生抗原-抗体反应,根据明胶颗粒在孔中的凝集情况判读结果。PA试剂有两种,HIV-1和HIV-2抗原共同致敏的PA试剂(AFD HIV-1/2 PA),已经我国食品药品监督管理局(SFDA)注册批准;HIV-1、HIV-2抗原分别致敏的PA试剂(SERODIA-HIV-1/2)可初步区分HIV-1型和HIV-2型,目前我国尚未引进。
(2)斑点EIA或称斑点ELISA(dot-EIA):以硝酸纤维膜为载体,将HIV抗原滴在膜上成点状,即为固相抗原。加血清样品作用,以后步骤同ELISA。阳性结果在膜上抗原部位显示出有色斑点。反应时间在10 min以内,使用抗原量少。
(3)斑点免疫胶体金(或胶体硒)快速试验:与斑点EIA相似,也是以硝酸纤维膜为载体。区别在于不用酶标记抗体,而代之以红色的胶体金(或胶体硒)A蛋白,用渗滤法作为洗涤方法。试剂稳定,可室温长期保存。试验时不需任何设备,迅速、简便、特异性较好,敏感性约相当于中度敏感的ELISA,适用于应急检测、门诊急诊个体检测。目前已有在国内被SFDA批准注册的国外进口试剂和国内产品。一般可在10~30min内判读结果。
(4)艾滋病唾液检测卡:在硝酸纤维膜上包被人工合成的HIVgp41/gp36蛋白抗原,可同时检测含在唾液中的HIV-1/HIV-2抗体,原理为酶免疫间接法。主要检测唾液中的HIV IgA与IgG抗体,敏感性特异性与ELISA相近,可避免静脉穿刺。但样品预处理时间长且售价较高。以唾液为样品测定HIV抗体的ELISA、免疫印迹法(WB)试剂已经美国FDA批准。
(5)其它快速筛查试验方法:家庭HIV检测(Home Access System)等。
1996年美国FDA首次批准HIV-1尿液ELISA试剂,我国也正在研制尿液HIV抗体检测试剂。主要适用于静脉注射毒品(IDUs)人群和其它高危人群的大面积流行病学调查、监测。筛查阳性者仍需采血做确认试验才能确定。
根据检测目的选用符合要求的筛查试剂对样品进行初筛和重复检测(复检)。
(1)实验准备:试验开始前将试剂和样品放置在室温(18~
磷酸盐缓冲液:若液体内有结晶,应放置在
TMB底物液:使用前配制,TMB液和过氧化脲液等量混匀。
备好试剂盒、待检样品和外部对照质控血清后,按试剂盒说明书以及质控和安全防护要求进行筛查检测。
(2)实验操作
①装好所需使用数目的孔条,每孔均加入100μl样品稀释液。设3个阴性对照孔,1个HIV-1阳性对照孔,若需要可再设1个HIV-2阳性对照孔。
②每孔加入50μl待检样品及对照(对照要后加),未用孔用样品稀释液加满以溶解结合物球,以免堵塞洗板机孔。可震摇15S,37±
③置洗板机上洗涤6遍(用洗液将反应孔完全加满,静置30~60S,共洗涤6遍,洗完后孔上方及底部不应残存液体,禁止在滤纸上拍干)。
④每孔加入100μl底物液,勿搅动,室温避光孵育30±2min。
⑤每孔加入100μl
⑥在2h内置于酶标仪读数,单波长450nm,或双波长450/630nm测OD值。
(3)实验结果
①阴性对照(NC),HIV-1阳性对照(PC1),HIV-2阳性对照(PC2)
NC 必须<0.25方可用,排除NC≥0.25的值,计算NC平均值。
NC界限范围:0.6倍NC均值<NC<1.4倍NC均值。
②符合以下条件的实验成立:
两个以上的NC可用。
PC1-NC均值 ≥ 0.4,PC2-NC均值 ≥ 0.4
③Cut off值 = 阴性对照均值 + 0.100
小于Cut off为阴性,大于或等于Cut off为阳性
(4)报告:对呈阴性反应的样品,可由实施检测的实验室出具HIV抗体阴性报告;对呈阳性反应的样品,须进行复检,不能出阳性报告。
对HIV抗体筛查试验,呈阴性反应者可出具“HIV抗体阴性”报告(可用附表1);对初筛试验呈阳性反应者不能出阳性报告,可出具“HIV抗体待复查”报告(附表1)。
如需送上级实验室进行复测或确认,需要填写“HIV抗体复测送检单”(附表2),经1名检验人员和1名具有中级以上技术职称的人员审核签字。送当地艾滋病筛查中心实验室,再转送艾滋病确认实验室,或在本实验室复检后直接送确认实验室。
5.2 HIV抗体确认试验
必须是经国家食品药品监督管理局注册批准、在有效期内的试剂。
包括免疫印迹试验(WB)、条带免疫试验(LIATEK HIVⅢ)、放射免疫沉淀试验(RIPA)及免疫荧光试验(IFA)。国内常用的确认试验方法是WB。
有HIV-1/2混合型和单一的HIV-1或HIV-2型。先用HIV-1/2混合型试剂进行检测,如果呈阴性反应,则报告HIV抗体阴性;如果呈阳性反应,则报告HIV-1抗体阳性;如果不满足阳性标准,则判为HIV抗体检测结果不确定。如果出现HIV-2型的特异性指示条带,需用HIV-2型免疫印迹试剂再做HIV-2的抗体确认试验,呈阴性反应,报告HIV-2抗体阴性;呈阳性反应则报告HIV-2抗体血清学阳性,并将样品送国家参比实验室进行核酸序列分析,见图2。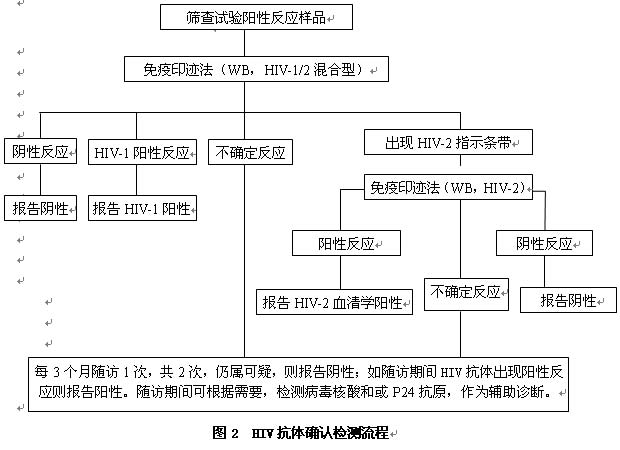
下面是我国使用WB确认HIV感染的判定标准和判定结果的基本原则。在实际工作中还应参照所用试剂盒说明书综合判定,遇疑难情况应报上级实验室解决。
至少有2条env带(gp41和gp160/gp120)出现,或至少1条env带和p24带同时出现。
同时符合以下2条标准可判为HIV-2抗体血清学阳性:
(1)符合WHO阳性判定标准,即出现至少2条env带(gp36和gp140/ gp105)。
(2)符合试剂盒提供的阳性判定标准。
无HIV抗体特异带出现。
出现HIV抗体特异带,但不足以判定阳性。
注:①HIV-1抗体特异带包括:env带:gp160/gp120、gp41;gag带:p55、p24、p17(或p18);pol带:p66(或p65)、p51、p31。②HIV-2抗体特异条带包括:env带:gp140/gp105、gp36;gag带:p56、p26、p16;pol带:p68、p53、p34。(由于使用的毒株不同,HIV-2 env带也可为gp125/gp80、gp36)。
确认试验由确认实验室根据检测结果出具“HIV抗体确认检测报告单”(附表3),报告HIV抗体阳性(+)、HIV抗体阴性(-)及HIV抗体不确定(±)。
(1) 随访复检:每3个月随访复检1次,连续2次,共6个月。如果检测时暴露时间已超过3个月,则在3个月后随访1次即可。将前后2份样品同时检测,仍呈不确定或阴性则报告HIV抗体阴性,如果在随访期间发生带型进展,符合HIV抗体阳性判定标准则报告HIV-1或HIV-2抗体阳性。
(2) 必要时可做HIV-1 P24抗原或HIV核酸测定,但检测结果只能作为辅助诊断依据,确认报告要依据血清学随访结果。
6 HIV抗体检测的替代策略
除上述常规检测程序以外,可以根据不同的目的,对HIV流行强度不同的地区和不同人群采用不同的替代策略,见表1。
表1 HIV抗体检测的替代策略
|
目的 |
地区 |
人群 |
替代策略 |
|
艾滋病疫情报告 |
任何地区 |
任何人群 |
替代策略Ⅰ |
|
VCT |
高流行地区 |
高危人群 |
替代策略Ⅱ |
|
高流行地区 |
一般人群 |
替代策略Ⅲ | |
|
其它地区 |
任何人群 |
替代策略Ⅲ |
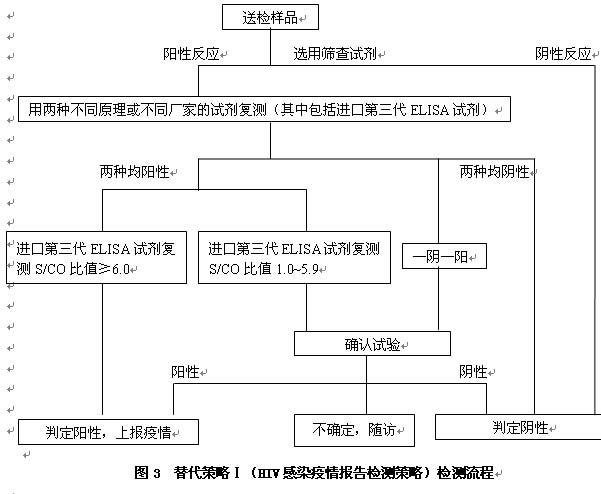
6.1 替代策略Ⅰ(HIV感染疫情报告检测策略)
全国HIV 感染疫情报告。
6.2 替代策略Ⅱ(高危人群VCT检测策略)
HIV感染高流行地区高危人群的VCT。应在确认中心实验室和确认实验室或以上实验室指定的筛查实验室进行,用高质量筛查试剂检测及判断结果(见

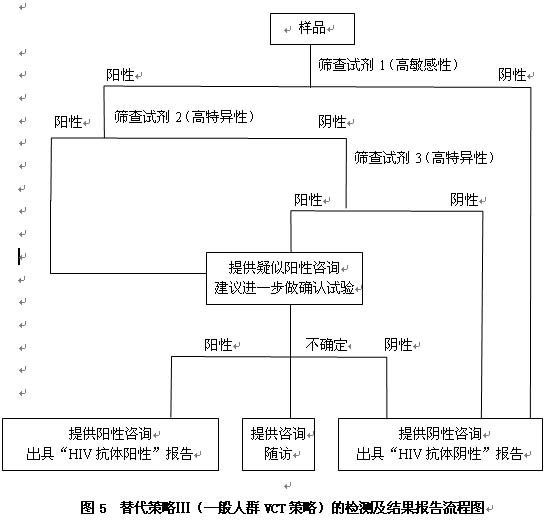
6.3 替代策略Ⅲ(一般人群VCT检测策略,图5)
HIV高流行地区一般人群检测及其它地区各类人群的VCT检测。
7 HIV抗体检测情况季报的时间和程序(图6)
7.1 艾滋病筛查实验室和艾滋病检测点应于每季度首月5日前填写“HIV抗体检测数季报表”(附表6),向艾滋病筛查中心实验室报告上季度检测情况。没有艾滋病筛查中心实验室的地区可直接向艾滋病确认中心实验室报告。
7.2 艾滋病筛查中心实验室应于每季度首月10日前将本实验室和本辖区内各筛查实验室上季度报告的检测情况(附表6)汇总,报告艾滋病确认中心实验室。
7.3 艾滋病确认实验室应于每季度首月10日前将上季度检测情况汇总后(附表6),报告当地艾滋病确认中心实验室和同级卫生行政部门。
7.4 艾滋病确认中心实验室应及时收集、整理和分析辖区内HIV抗体检测情况,于每季首月15日前向省级卫生行政部门和中国疾病预防控制中心性病艾滋病预防控制中心(简称中国疾控中心性艾中心)参比实验室报告。同时,按艾滋病疫情报告的有关规定上报疫情。
7.5 在非送检样品中(如专项调查与研究等)发现的艾滋病病毒抗体阳性者,应向所在地的省疾病预防控制中心报告, 并填写“HIV抗体确认检测报告单”(附表3),报中国疾控中心性艾中心参比实验室。
7.6 实验室上报检测结果的同时,应随时报同级监测人员,以便及时随访调查。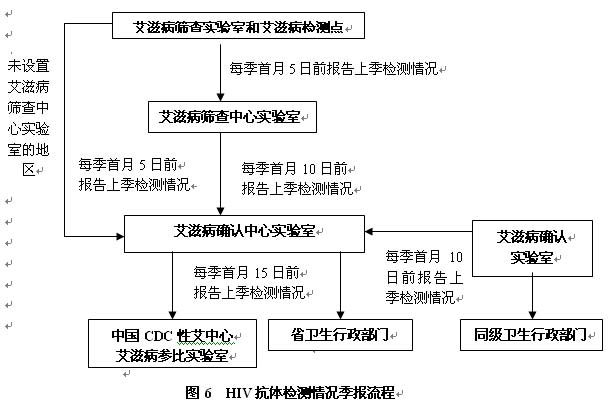
第三章 HIV核酸定性检测
1 范围
本章规定了核酸检测、核酸序列测定的实验室条件、检测方法及结果判定标准,适用于HIV核酸的定性检测。
2 规范性引用文件
卫生部关于印发《临床基因扩增检验实验室管理暂行办法》的通知(卫医发[2002]第10号)
Butcher A, Spadoro J: Using PCR for detection of HIV-1 Infection. Clin Imm Newsletter, 12:73:76, 1992. http://www.niaid.nih.gov/daids/vir_manual/full_vir_manual.pdf
3 实验室条件
3.1 实验室功能分区
试剂准备区、样品处理区、扩增区和扩增产物分析区,并设在不同房间。前两区为扩增前区,后两区为扩增后区。各区的功能是:
(1)实验前将次氯酸钠溶液或70%乙醇涂布于操作台或器具表面,两分钟后用纸巾擦除。
(2)移入盛放污染材料的器皿、所需的试剂、耗材和样品,进行试验。
(3)一个实验区域在同一时间段只进行一种实验。
(4)实验结束后移出个人专用材料至个人专用区域;封好污染材料盛放器皿并移至污物袋;移出共享器具至专门区域保管;将次氯酸钠溶液或70%乙醇涂布于操作台或器具表面,两分钟后用纸巾擦除;打开紫外灯照射至少15min。
3.2 人员
进行HIV核酸检测的人员须具有艾滋病检测实验室的上岗资格,并接受过省级以上艾滋病实验室生物安全及实验操作技术培训。
3.3 设施和设备
4 方法和试剂
4.1 方法
阳性对照:与待测样品同质、含有目的基因片段的标本。
阴性对照:与待测样品同质、不含有目的基因片段的标本。
空白对照:不含模板的扩增试剂。
4.2 试剂
每个实验室使用的方法不尽相同,下面所列试剂供参考。
以检测为目的一般使用HIV gag和/或pol和/或env和/或其它基因区的引物、进行HIV-1的基因亚型测定常使用HIV-1 gag 和/或pol和/或env基因区的引物。在进行RNA逆转录时可使用扩增的下游特异性引物或随机引物,可参考文献的引物序列或自行设计引物,应尽量涵盖常见的HIV毒株,也可使用复合引物。
包括核酸提取纯化、逆转录、PCR所需的试剂。
主要有:DNA/RNA提取试剂盒、细胞裂解缓冲液、蛋白酶K、TAE缓冲液、逆转录酶及其缓冲液、RNA酶抑制剂、PCR反应缓冲液、DNTPs、Taq酶。
5 扩增目的基因片段
5.1 样品的采集和处理
见第一章“样品的采集和处理”。
5.2 核酸提取
严格按照商业用试剂盒说明书操作。提取RNA时应注意防止RNA降解。DNA于
5.3 逆转录
将RNA模板、逆转录引物、dNTP、逆转录酶、RNA酶抑制剂、缓冲液和适量无RNA酶的超纯水加入反应管中,在适宜温度下进行逆转录反应,合成cDNA。
5.4 PCR扩增
将模板(DNA或cDNA)、dNTP、引物、缓冲液、Taq酶和适量灭菌纯水加入反应管中,置于扩增仪上,按照设定的程序进行扩增。
6 扩增产物分析及结果报告
6.1 常用的扩增产物分析
常用的扩增产物分析方法是电泳法,与分子量标准比较,判断扩增片段是否在预期的分子量范围内。其它扩增产物分析方法还有酶切、杂交、序列分析等。
6.2 结果判定和报告
所有的标本都应做双份平行检测,阳性结果还要用扩增另外一个基因区的一对引物进行进一步检测。每一次检测都至少同时做两个阳性对照和两个阴性对照,只有在阳性对照扩增出预期的片段、阴性对照没有扩增片段、双份平行标本结果一致的情况下,实验才成立。标本的任何两个基因区(env和gag ,或env和pol,或gag 和pol或其它两种基因组合)呈阳性才能判定为阳性结果。
只可报告本次实验结果阴性。
可作为诊断HIV感染的辅助指标,不单独用于HIV感染的诊断。
7 实验室管理
HIV核酸检测实验室应制定严格的管理制度,工作人员必须充分了解各项规定并严格遵照执行。
7.1 生物安全
必须符合艾滋病实验室的通用生物安全要求。
7.2 严格执行分区制度
7.3 仪器和材料的专用制度
仪器、设备、材料、设施均应按工作区域进行标识,不得交叉混用。
7.4 单向流向制度
7.5 废弃物处理制度
第四章 HIV RNA定量测定(病毒载量测定)
1 范围
本章规定了测定HIV病毒载量常用方法的实验室条件、方法、结果判定以及应用,适用于血浆中HIV病毒载量的测定。
2 规范性引用文件
Guidelines for the Use of Antiretroviral HIV-Infected Adults and Adolescents MMWR Recommendations and Reports April 24, 1998/47(RR-5); 42-82.
Chiron® Product insert (Quantiplex® HIV-RNA), L6170 rev 5.0, June 1994 Roche AMPLICOR HIV MONITOR™ TEST Procedure Manual.
Fractions of HIV-1 Seropositive Persons by Two Nucleic Acid Amplification Assays, AIDS. Research and Human Retrovirus 1993; (9):259-265. http://www.niaid.nih.gov/daids/vir_manual/full_vir_manual.pdf
3 实验室条件
3.1 实验室功能分区
试剂准备区、样品处理区、扩增区和扩增产物分析区,并设在不同房间。前两区为扩增前区,后两区为扩增后区。各区的功能是:
(1)实验前将次氯酸钠溶液或70%乙醇涂布于操作台或器具表面,两分钟后用纸巾擦除。
(2)移入盛放污染材料的器皿、所需的试剂、耗材和样品,进行试验。
(3)一个实验区域在同一时间段只进行一种实验。
(4)实验结束后,移出个人专用材料至个人专用区域保管;封好污染材料盛放器皿并移至污物袋;移出共享器具至专门区域保管;将次氯酸钠溶液或70%乙醇涂布于操作台或器具表面,两分钟后用纸巾擦除;打开紫外灯照射至少15min。
<, FONT size=3>3.2 人员
进行HIV核酸检测的人员须具有艾滋病实验室的上岗资格,并接受过省级以上艾滋病实验室安全及实验操作技术培训。
3.3 设施和设备
4 方法和试剂
4.1 方法
常用的HIV RNA定量测定方法有逆转录PCR试验(RT-PCR)、核酸序列扩增试验(NASBA)、分支DNA杂交试验(bDNA)。不同病毒载量检测方法的比较见表2(John G. Bartlett M.D.and Joel E.Gallant M.D., Medical Management of HIV Infection 2004 Edition p1-5)。
表2 不同病毒载量检测方法的比较
|
|
Roche |
Bayer |
bioMerieux |
|
商品名 |
Amplicor |
Versant |
NucliSens |
|
技术原理 |
RT-PCR |
bDNA |
NASBA |
|
结果比较 |
RT-PCR试验的结果近似于2.0或3.0版bDNA试验的结果 |
bDNA2.0版或3.0版的试验结果与Roche RT-PCR实验的结果具有可比性 |
结果与RT-PC R和bDNA具有可比性,但支持性资料少于前者 |
|
优点/缺点 |
与Bayer 的方法相比假阳性较少。 已获FDA批准。 |
需要时间较短。 动态范围广。 已获FDA批准。 |
能够使用组织或体液样品,例如阴道分泌物。 动态范围最大。 已获FDA批准。 |
|
动态范围 |
标准:(1.5版) 400 超敏:(1.5版) 50 |
bDNA3.0版: 75 |
Nuclisens HIV 176 取决于标本量 |
|
扩增的亚型 |
1.0版:只有B亚型 1.5版:B-G |
A-H |
A-G |
|
标本量 |
Amplicor-0.2ml 超敏-0.5ml |
1ml |
10μl-2ml |
|
抗凝剂 |
EDTA |
EDTA |
EDTA、肝素、全血、任何体液、PBMC、精液、组织等 |
|
要求 |
6小时之内分离血浆,运输前在 |
4小时之内分离血浆,运输前在 |
4小时之内分离血清或血浆,运输前在 |
4.2 试剂
HIV RNA定量检测包括bDNA、RT-PCR、NASBA试剂。
5 实验室管理
HIV核酸检测实验室应制定严格的管理制度,工作人员必须充分了解各项规定并严格遵照执行。
5.1 生物安全
必须符合艾滋病实验室的通用生物安全要求。
5.2 严格执行分区制度
5.3 仪器和材料的专用制度
仪器、设备、材料、设施均应按工作区域进行标识,不得交叉混用。
5.4 单向流向制度
5.5 废弃物处理制度
5.6 质量控制和评价
6 HIV核酸定量检测的意义
6.1 辅助诊断
在一般情况下,HIV抗体检测足以对HIV感染与否做出正确诊断,但在特殊情况下,单纯抗体检测不足以完成明确的判定,如出现某些非典型的抗体反应形式,特别是不确定反应时,RNA的测定可提供非常有用的证据。虽然单纯使用RNA测定不能完全确定感染与否,但当RNA测定出现较高拷贝数的阳性结果时(>3,
需要指出的是,每一种RNA定量系统都有其最低检测限,即可以测出的最低拷贝数,通常在50~
6.2 早期诊断
在HIV感染的窗口期无法使用抗体检测进行诊断。而在感染早期,在抗原峰出现前后通常出现一个病毒载量的高峰,此高峰通常高于发病时的血浆病毒水平,并且有证据表明这个时期的病毒具有很高的感染能力。这个高峰在免疫系统产生反应后,尤其是在细胞免疫出现后开始下降。因此早期病毒RNA测定具有特殊的意义。该方法也可用于HIV感染孕妇所生婴儿的早期辅助诊断。
目前国际上正在尝试使用这种检测对采供血样品进行多个样品混合后的RNA检测以减少窗口期危险(降低“残余危险度”)。
6.3 病程监控
根据HIV感染发生后病毒载量具有一定的变化规律,并且这种变化与疾病的进程有着密切的相关性。因此定期进行病毒载量的检测有助于确定疾病发展的阶段,以确定相应的治疗方案。
通常在HIV感染后无症状期内发生的感染或其它临床症状很难与AIDS发病时的症状区别,为确定一个刚发生的症状是否与HIV的感染有关,医生往往需要观察病人的实验室指标,病毒载量就是一个非常重要的指标。
6.4 指导治疗方案及疗效判定
临床实践证明,并非在任何情况下HIV感染者都应该进行抗病毒治疗。这不单是经济上的原因,更重要的是由于抗病毒药物的副作用和疗效原因。通常在病毒载量达到一定水平后(如>35,000~50,
在进行治疗后,通过病毒水平的检测才能确定治疗是否有效,通常在治疗前后病毒水平降低0.5 log以上才被认为临床有效。
6.5 预测疾病进程
HIV感染后疾病进程与病毒载量的关系十分密切,观察HIV感染者病毒RNA水平可大致预测其发病的可能。病毒载量与6年发病率的关系为:<
当HIV感染者CD4+T细胞计数<200/μl时,病毒载量与3~6个月发展至AIDS的危险为:<10,
第五章 CD4+ 和CD8+ T淋巴细胞检测
1 范围
本章规定了用多平台三级程序法和单平台一步法检测全血中的CD4+ 和CD8+ T淋巴细胞。
2&nb, sp; 规范性引用文件
1997 Revised Guidelines for Performing CD4+ T-Cell Determinations in Persons Infected with Human Immunodeficiency Virus (HIV) MMWR 46(RR-2);1-29 Publication date:
3 实验室条件
3.1 人员
进行HIV感染者CD4+ 和CD8+ T淋巴细胞检测的人员须具有艾滋病实验室的上岗资格,并接受过省级以上艾滋病实验室安全及实验操作技术培训。
3.2 设施和设备
3.3 功能分区
实验室原则上应分为样品处理区和流式细胞仪检测区,各区的功能是:
4 样品采集、运输和接收
4.1 样品的采集
(1) EDTA(1.5±0.15mg/ml血液)。
(2)在血球分析仪生产商允许的时间范围内检测,不超过30h,不检测超出抗凝时间范围的样品。
(1)用K3EDTA抗凝,收集样品应在30h以内,尽早(8h以内)处理。
(2)用ACD或肝素抗凝,收集样品在48h以内,尽早(8h以内)处理。
4.2 样品运输
4.3 样品接收
5 方法
目前用于CD4+ 和CD8+ T淋巴细胞计数的检测方法分为自动检测方法和手工操作法。自动检测方法包括流式细胞仪(主要有多平台三级程序法和单平台一步法)和专门的细胞计数仪,手工操作法包括几种手工操作试验,需要显微镜或酶联免疫试验设备。
6 实验资料的记录
6.1 实验应及时、准确地记录结果。
6.2 实验记录中应包括以下内容:日期、操作者、所有样品、实验内容、过程(步骤)、结果及有无事故等。
6.3 整个实验室的实验资料要统一有专人负责,按固定格式记录在案。
6.4 计算机生成的实验结果,存档备案;定期拷贝计算机结果文档,备案保存。
7 结果报告
7.1 按照实验结果填写CD4+ 和CD8+ T淋巴细胞检测报告单,检测人员签字。
7.2 根据CD命名标准报告数据,用一个简短的描述解释命名的意义。注意:CD4+T细胞是指辅助性T细胞。正确的报告CD4+ T细胞应该是那些CD4+ 和CD3+ 双阳性的细胞。同样地,CD8+ T细胞是T-suppressor/cytotoxic细胞,为CD3+ 和CD8+ 双阳性的细胞。在CD4+ 和CD8+ 的判定中重要的是排除其它细胞(非T细胞)的干扰。
7.3 以全部淋巴细胞的百分比报告数据,并且修正门内淋巴细胞纯度。例如,如果淋巴细胞纯度是94%,而CD3值为70%,可以通过0.7除以0.94乘以100得到74%,修正CD3的值。
7.4 为检测免疫亚群而取血的同时,用该血样作自动测定全血细胞(CBC)计数白细胞(WBC)及分类测定,报告淋巴细胞亚群绝对数值。
7.5 单平台一步法由计算机软件直接出结果并打印出报告单,报告单的内容包括如下结果:CD45+ Abs Cnt;CD3+ Abs Cnt;CD3+ CD4+ %T Lym;CD3+CD4+ Abs Cnt;CD3+CD8+ %T Lym;CD3+CD8+ Abs Cnt;Th/Ts及其正常参考值范围(BD公司建立的正常参考值范围见表3),检测人员签字。
表3 BD公司应用单平台一步法建立的正常参考值范围表
|
项 目 |
单 位 |
参考正常值范围 |
|
CD3+/ CD45+ |
% |
56%~85% |
|
CD3+绝对数 |
个/μl |
1027~2086 |
|
CD3++ CD8+/ CD45+ |
% |
15%~34% |
|
CD3++ CD8+绝对数 |
个/μl |
323~836 |
|
CD3++ CD4+/ CD45+ |
% |
30%~54% |
|
CD3++ CD4+绝对数 |
个/μl |
706~1125 |
|
CD4+/ CD8+比值 |
|
1~2* |
*另有报告: ①0.68-2.47(中华检验医学杂志,2003,26(2):123-125)
②0.71-2.87(中华检验医学杂志,1998,21(4):223-227)
③1.38±0.34(中华检验医学杂志,1998,21(2):98)
7.6 应报告所有相关数据的正常值范围(如CD4+T淋巴细胞百分率和绝对数)。每个实验室都应测定参考数值。应分别建立成人和儿童的正常值参考范围,在对病人样品检测时应使用合适的参考值。
7.7 报告单经复核人复核签字及签发,加盖检验专用公章后发出。
7.8 报告发放时,可经挂号邮寄或直接交给送检人。
8 质量控制和评价
制定质量保证计划,建立内部质量控制制度。参加室间质量评价。正常参考数据见7.5。
9 检测CD4+、CD8+ T淋巴细胞的意义
T淋巴细胞是机体免疫系统内功能最重要的一群细胞。在正常机体内各淋巴细胞亚群相互作用,维持着机体正常免疫功能。当不同淋巴细胞亚群的数量和功能发生异常时,可导致机体免疫功能紊乱并发生一系列病理变化。因此,T淋巴细胞亚群的免疫分型能够提供有关患者免疫状态的重要信息。AIDS是由HIV引起的一组综合征,HIV主要侵犯人CD4+ T淋巴细胞,导致其数量上的减少和功能缺陷,使机体免疫平衡被打破造成免疫功能低下,最终导致各种机会感染和肿瘤。因而,对HIV感染者和AIDS病人定期进行CD4+、CD8+T淋巴细胞 检测具有十分重要的意义。主要表现在以下几个方面:
9.1 了解机体的免疫状态以进行疾病分期,如美国CDC就是以此为基础制订了HIV感染者/AIDS病人的诊断和分类标准(见表4),目前国内外仍被采纳应用。
表4 1993年修订的HIV感染的分类系统和青少年及成人扩展的AIDS监测病例定义
|
CD4+T淋巴细胞数范围 |
临床分类 | ||
|
A 无症状,急性(原发) |
B 有症状,非(A)或(C) |
C 艾滋病指征性疾病 | |
|
1.≥500/μl (≥29%) |
A1 |
B1 |
C1 |
|
2.200~499/μl (14%~28%) |
<, P class=MsoNormal align=center center TEXT-ALIGN: 125%;>A2 |
B2 |
C2 |
|
3.200/μl (<14%) |
A3 |
B3 |
C3 |
备注:A、B、C的解释请参考《艾滋病病毒感染的诊断与治疗》邵一鸣、蒋岩、栾文民主译,
科学出版社,2002年。
9.2 长期监测CD4+ T淋巴细胞绝对数的变化,有助于了解患者的病情发展,决定正确的治疗方案,并观察对治疗的反应。如判断HIV感染者的临床合并症(当CD4+ T淋巴细胞细胞<200/ml时,很容易发生卡氏肺孢子虫肺炎;当CD4+ T淋巴细胞<50时,易发生CMV感染)。
9.3 帮助确定抗HIV药物治疗及预防机会性感染治疗的适应症,如当CD4+ T淋巴细胞<200/ul时,应给予抗卡氏肺孢子虫肺炎的预防性治疗。
9.4 是用来评价一些新的、针对HIV的治疗方法和治疗药物疗效的重要指标。
第六章 HIV抗原检测
1 范围
本章规定了P24抗原的检测方法适用于HIV-1 P24抗原的检测。
2 规范性引用文件
Guidelines for the BLOOD TRANSFUSION SERVICES IN THE
MMWR 45 (RR-2);1-9,Publication date:
http://www.niaid.nih.gov/daids/vir_manual/full_vir_manual.pdf
3 实验条件
3.1 人员
从事HIV-1抗原检测的人员须具有艾滋病实验室的上岗资格,并接受过省级以上艾滋病实验室安全及实验操作技术培训。
3.2 设施和设备
生物安全柜(生物安全II级)、离心机、加样器、冰箱、酶标仪;洗板机。
3.3 防护用具
专用的工作服、隔离衣、帽子、鞋套、防护眼镜、口罩及手套。
3.4 实验材料
HIV-1 P24抗原检测试剂盒、酶标板、移液器。
4 抗原检测
4.1适用范围
4.2 试剂
一般用ELISA双抗体夹心法试剂,必须经过国家食品药品监督管理局批准注册、在有效期内的试剂。
5 HIV P24抗原检测方法
P24抗原的检测通常是采用ELISA夹心法,已知抗体包被固相反应板孔底,加入待测血清,若血清中含有P24抗原则与包被抗体形成抗原-抗体复合物,再加入酶(HRP)标记的HIV-1抗体与抗原结合,加底物显色,在酶标仪上读结果。
为了提高检测血清中P24抗原的敏感性,需先将血清中免疫复合物解离后再进行测定,目前已发展了ICD P24抗原(immun-complex disassociate,免疫复合物解离,ICD)测定试剂,用于HIV-1 P24抗原测定。即使将复合物解离,敏感性提高,也只能在大约50%无症状感染者中检出P24抗原。
5.1 试验准备
5.2 试验操作
5min内,每孔加入
5.3 试验结果
5.4 结果报告和解释
第七章 艾滋病实验室安全防护和职业暴露预防
1 范围
本章规定了艾滋病实验室安全防护和职业暴露预防。
本规范适用于全国各级各类艾滋病实验室的安全防护和职业暴露预防。
2 规范性引用文件
《医务人员艾滋病病毒职业暴露防护工作指导原则(试行)》中华人民共和国卫生部,
《实验室生物安全通用要求》GB 19489-2004,
《微生物和生物医学实验室生物安全通用准则(WS 233-2002)》中华人民共和国卫生行业标准,
Guidelines for the Safe Transport of Infectious Substances and Diagnostic Specimens .WHO 1997.
Biosafety in Microbiological and Biomedical Laboratories, CDC/NIH, Fourth Edition, 1999.
Update: Provisional recommendations for chemoprophylaxis after occupational exposure to Human Immunodeficiency Virus MMWR. 1996;45:468-472, and from B Schoub. Virus SA . 1997. Guidelines to the Management of Occupational Exposure to HIV. National
《消毒技术规范(2002年版)》中华人民共和国卫生部
3 实验室生物安全级别
3.1 艾滋病血清学检测
艾滋病血清学检测(包括筛查和确认实验室)、免疫学和核酸检测应在符合Ⅱ级生物安全实验室(BSL-2)要求的艾滋病检测实验室中进行。
3.2 HIV分离、研究
HIV分离、细胞培养及研究工作应在Ⅲ级生物安全实验室(BSL-3)中进行。
4 实验室安全防护
4.1 个人防护及保健
艾滋病实验室所用的个人防护装备均应符合国家有关标准的要求。
4.2 实验室管理要求
各级实验室血清库/毒种库的设置按有关规定执行。
4.3 实验室的安全操作
4.4 避免利器的使用
4.5 样品的采集
所有的血液、血清、未固定的组织和组织液样品,均应视为有潜在传染性,都应以安全的方式进行操作。
4.6 带入和带出实验室的物品
5 废弃物处置和消毒
5.1 废弃物处置
5.2 HIV常用的消毒方法
HIV最常用的化学消毒剂是含氯消毒剂(次氯酸钠,含有效氯2000-5000mg/L)、75%乙醇和2%戊二醛,保持10~30 min。
6 实验室意外和事故处理
6.1 意外和事故
6.2 意外和事故的紧急处理措施
发生意外事故时,应立即进行紧急处理,并报告实验室负责人。
(1)从污染处疏散人员,但要防止污染扩散;
(2)控制污染——锁门并防止进一步进入;
(3)通知实验室主管领导、安全负责人等,以便查清情况,确定消毒处理的程序;
(4)如果认为合适,可进行生物安全柜和/或实验室的低温蒸汽甲醛气体消毒,但生物安全柜和/或实验室必须有可靠的密闭性能,人员必须完全离开。【生物安全柜:25ml福尔马林和等量水混合后放在一个蒸发皿中使其在密封的生物安全柜中蒸发,保持至少6h,最好过夜。实验室:福尔马林和水的体积根据实验室大小而定】。具体操作可按说明书执行。
(5)发生溢出后应离开房间约30分钟。 穿防护服,被溅的地方用经消毒剂浸泡的吸水物质覆盖;消毒剂起作用10-15分钟后清理该地方。移走吸水性物质,用消毒剂冲洗该地方。
6.3 意外和事故登记、报告和检测
7 艾滋病的职业暴露后预防
7.1 职业暴露
艾滋病的职业暴露是指医务工作者、实验室工作人员及有关监管人员在从事HIV/AIDS诊断、治疗、护理、预防、检验、管理工作过程中,暴露于含有HIV的血液、体液和实验室培养液,即暴露于含有HIV的液体等引起的危害。
7.2 HIV/AIDS的职业暴露后预防
HIV/AIDS的职业暴露后预防(Postexposure Prophylaxis,PEP)应包括急救、对暴露级别的评估、暴露源严重程度的评估、预防性用药的推荐处理方案、报告与保密。
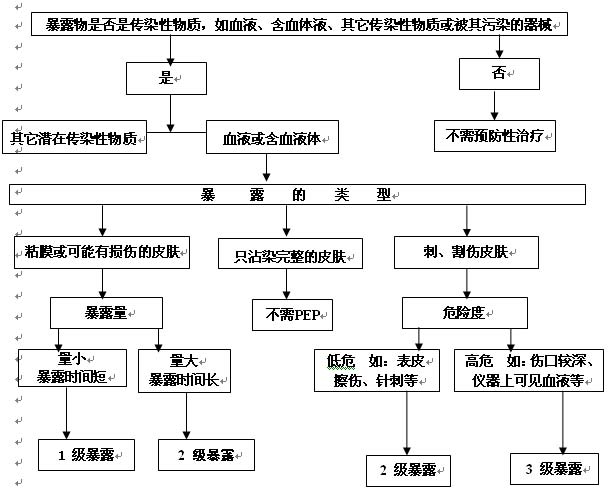
7.2.3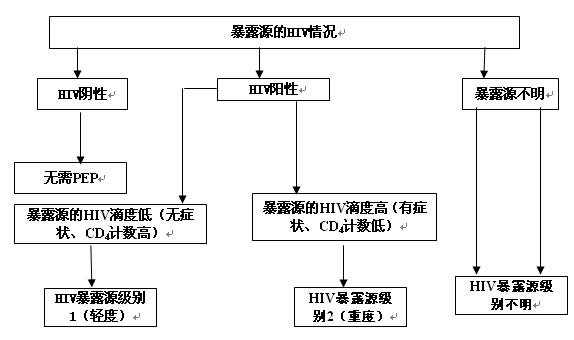
表5 职业暴露后预防性用药的处理方案
|
暴露级别 |
暴露源级别 |
预防性用药推荐处理方案 |
|
1 |
1 |
不一定使用PEP,可由职业暴露者本人根据利害比较作出决定 |
|
1 |
2 |
使用基本用药程序(1) |
|
2 |
1 |
使用基本用药程序 |
|
2 |
2 |
使用强化用药程序(2) |
|
3 |
1或2 |
使用强化用药程序 |
|
不明 |
暴露源级别不明 |
使用基本用药程序 |
注:(1)基本用药程序:两种逆转录酶制剂,使用常规治疗剂量,AZT(每次200mg,每日3次,或每次300mg,每日2次)+拉米夫定(每次150mg每日2次),连续使用28d。或双汰芝(AZT与3TC联合制剂)300mg/次,每日2次。,
(2)强化用药程序:基本用药程序加一种蛋白酶抑制, 剂,茚地那韦(800mg,tid,饭前1h及饭后2h服用),均使用常规治疗剂量。
(1)如果存在用药指征,则应当在暴露后尽快开始PEP。
(2)暴露后72h内应当考虑对暴露者进行重新评估,尤其是获得了新的暴露情况或源患者资料时。
(3)在患者可耐受的前提下,给予4周的PEP。
(4)如果证实源患者未感染HIV,则应当立即中断PEP。
(1)职业暴露登记制度:职业暴露事故的事故发生单位应建立“艾滋病职业暴露人员个案登记表”(附表7),对职业暴露情况进行登记、保存和上报。详细记录职业暴露发生的时间、地点及经过;暴露方式;损伤的具体部位、程度;暴露物种类(培养液、血液或其它体液)和含有HIV的情况;处理方法及处理经过(包括赴现场专家或领导活动);是否采用暴露后预防药物,并详细记录用药情况、首次用药时间(暴露后几小时或几天)、药物毒副作用情况(包括肝肾功能化验结果)、用药的依从性状况。
(2)当地疾病控制部门为职业暴露处理单位,重大职业暴露发生单位应及时与当地疾控中心取得联系。当地疾控中心应与当地有关专家联系根据情况共同进行风险的评估,确定用药的必要性、确定预防药物和用药程序,并将处理情况向主管行政部门报告。
(3)监测暴露源:如果暴露源没有阳性或阴性的血清学化验结果应立即检测,最好做快速试验,因其结果可在几十分钟内得到。如果暴露源有急性HIV综合征的症状,应同时检测病毒载量。
(4)监测职业暴露者:由本省HIV监测(或确认)中心抽血检测职业暴露者的HIV-1/2抗体(包括做快速试验),该血清留样备用。如果职业暴露者以前已有HIV抗体的化验结果,则应加以记录。暴露后1年内要定期监测HIV抗体,即分别在暴露后4周、8周、12周、6个月监测。结果填写在报来的“艾滋病职业暴露人员个案登记表”(附表7)内。
(5)使用预防性用药,应注意监测药物的毒副作用,包括使用预防性治疗时和服药两周后的全血检测、肾功能和肝功检测。小型事故可在紧急处理后,立即将事故情况和处理措施报告主管领导和有关专家,以及时发现处理中的疏漏之处,使处理尽量完善妥当。不采取暴露后预防用药者,也要定期检测HIV抗体,检测时间同前。
(1)保密:无论职业暴露、重大事故或小型事故,对涉及的职业暴露者,均应注意做好保密工作。每一个得到信息的机构或个人均应做好保密工作。
(2)报告制度:各职业暴露处理单位及时将填报的“艾滋病职业暴露人员个案登记表”(附表7)报至本省疾病预防控制中心(简称省疾控中心)。每年1月10日和
8 安全药品储备点的建立及管理机制
8.1 各省应将职业暴露安全药物储备点(下称储备点)的工作纳入省卫生行政部门的艾滋病防治工作规划,尽快筹建贮备点,组建由疾病预防控制专家和临床专家组成的专家组,根据本省需求储备适量的职业暴露预防药品。
8.2 各省药物贮备点可设在省疾控中心,或卫生行政及其它系统的主管部门指定的单位。
8.3 各省和各系统筹建的贮备点,需在中国疾控中心性艾中心备案。
8.4 职业暴露安全药品由国家免费抗病毒治疗药品库统一调配。
8.5 各省和各系统的安全药品贮备点负责本辖区内或本系统职业暴露事故预防性用药,包括对暴露级别、暴露源头严重程度进行评估,确定用药方案,并负责事故后的咨询、技术指导、分析总结等工作。
8.6 各省药物储备点应严格按照本规范的要求做好药品的使用、发放、更新和管理以及事故的登记、处理和跟踪检测等工作。
第八章 艾滋病实验室质量管理
1 范围
本章规定了艾滋病实验室质量管理,包括质量保证、质量控制和质量评价,适用于全国各级各类艾滋病实验室的质量管理。
2 规范性引用文件
《全国艾滋病检测工作规范》,卫生部,1997。
ISO 15189, Medical Laboratories-Particular requirements for quality and competence (formerly Qualily Management in the Medical Laboratory).
NCCLS C24-A2. Statistical Quality Control for Quantitatire Measurements; Principles and Definitions; Approved Guideline-Second Edition.
3 质量保证(QA)
3.1 行政支持
行政部门和领导要关心艾滋病实验室的建设和发展,保证实验室负责人和主要技术人员队伍的稳定,保证实验室建筑和设备需要,给予充足的经费支持,并进行经常性监督检查。
3.2 实验室规范化建设
艾滋病实验室的设置及其建筑、设施、设备必须符合《全国艾滋病检测工作规范》的要求。
3.3 人员培训及其评价
实验室工作人员上岗前必须接受技术培训并获得合格证书。在工作中要定期或不定期接受复训。实验室主管领导应定期对工作人员进行评价,包括工作的准确性、效率、执行安全条例和规章制度情况、职业道德、出勤率以及上岗资格等。
3.4 标本采集、运送和处理
严格遵照本规范第一章。
3.5 检测方法和试剂的选择
应使用可靠的检测方法和敏感性高、特异性好的试剂,并定期进行质量评价。
3.6 设备维护与校准
设立常用仪器的维护及校准制度,以保证正常运转。
每天:核对滤光片波长,检查洗板机管道是否通畅,是否有漏液现象。
每周:清洁仪器表面,保护光学零件不沾灰尘。
每月:检查洗涤时各孔是否与相应的冲洗头对位良好,负压是否符合规定要求。
每年:检查、清洗滤光片,如果出现破裂或霉点则要更换。根据仪器内具有的校准程序或使用校准板,对滤光片的精密度进行校准并保留记录。
实验过程中发现异常情况,应随时进行处理,可根据使用情况更换必要的部件。
1年至少应该标定1次,发现异常情况应随时进行校准。
标定方法包括有色溶液光谱分析法、称量校准法、同位素计数法以及使用配套校准盒等。校准多道移液器时,必须保证每一个加样头都能够连续、准确地加样。移液器的精密度应在厂家说明书规定的范围内。
范例 用蒸馏水称量法标定移液器:
在室温
表6 称重法校准移液器方案
|
移液器规格 |
蒸馏水量 |
要求重量范围 |
|
0.5~10μl |
2μl |
1.75 ~ 2.25 mg |
|
5~40μl |
10μl |
9.8 ~ 10.2 mg |
|
40~200μl |
70μl |
69.4 ~ 70.6 mg |
|
200~1000μl |
300μl |
298.0 ~ 302.0 mg |
|
1~5ml |
2000μl |
1990.0 ~ 2010.0 mg |
|
2~10ml |
3500μl |
3485.0 ~ 3515.0 mg |
必须每天检查和记录低温、超低温冰箱及孵育箱的温度,并做好记录。
精密仪器及出具实验结果的仪器必须定期校准,其它仪器定期检查并做好记录。
3.7 文件和文件管理
(1)样品的接收、登记和处理,
(2)检测方法和步骤,
(3)仪器的使用维护和校准,
(4)实验中的质量控制,
(5)结果解释与报告,
(6)保密程序,
(7)检测数据的记录与保存,
(8)追踪和处理,
(9)实验室的清理和消毒,
(10)实验室安全防护。
(1)标题和编号
(2)编写和修改日期
(3)编写和修订人员姓名
(4)方法、目的和应用范围
(5)相应的职业规范
(6)检测设备和试剂
(7)安全防护相关步骤
(8)结果的解释和报告
(9)附录,包括相关的附加文件如标准表格、设备和试剂盒说明书等。
应按实验要求,设计操作的原始记录表,标明空白对照、阳性对照、阴性对照、外部对照以及待检样品的位置,便于指导实验人员加样。要注明试剂盒厂家、测定方法、批号、效期、操作人员和复核人员姓名及检测日期。
收到标本后,及时登记有关参数,包括受检者姓名或代号、试管编号、性别、年龄、职业、送检单位、人群类别、检验结果、送检日期、报告日期、备注 ( 必要时记录通信地址 )等。
包括HIV阳性标本的类型、贮存量、贮存温度、贮存起始时间以及标本保管人姓名。
实验原始记录表、打印数据、免疫印迹试验的膜反应条带或其照片、检测记录表、标本登记、标本保存记录以及仪器设备维修和校准记录等都应该妥善存档保存15年以上。最好同时使用计算机保存各种文件和记录。
4 质量控制(QC)
4.1 质控血清的制备和保存(以ELISA试验检测HIV抗体为例)
在每次实验中必须包含有内部对照质控血清和外部对照质控血清。
内部对照质控血清指试剂盒内提供的阳性和阴性对照血清。内部对照是质量控制的基础。每一次检测必须使用内部对照,而且只能在同批号的试剂盒中使用。
外部对照质控血清是为了监控检测的重复性和稳定性以及试剂盒批间或孔间差异而由实验室设置的一套对照血清,包括强阳性、弱阳性和阴性对照血清。也可以只设置一个弱阳性对照,以该试剂盒临界值(Cut-off)的2~3倍为宜。
HIV抗体阳性和阴性血清,
每一次实验必须使用外部对照质控血清,以便监控实验的重复性和稳定性。同时可以了解各批试剂盒的批间或孔间差异,绘制质量控制图。
质控物的管间或瓶间变异必须小于监测系统预期的变异(cv<20%),并且质控物的成分应在稳定状态中。质控物应无菌,并不含有影响ELISA反应的防腐剂。
4.2 质控图的建立及应用(以ELISA试验检测HIV抗体为例)
最常用的质控图是Levey-Jennings质控图,使用累计和技术或趋势分析技术的图形可提供系统偏移和漂移的状况。
外部对照质控物的平均值和标准差应建立在实验室常规使用方法对质控物重复测定的基础上。一般采用在不同批次检测取得至少20个数据;如果仅做少量批次的检测,也至少做5个批次的检测,每个批次中不少于4个质控物测定结果,以建立一个临时性的平均值和标准差,当达到20批次数据后,替代临时性的平均值和标准差。

质控图是把检测数据与已确定的(计算出的)“控制限”进行比较的图,包含一条中心横线和其上、下两条平行的控制线,并按时间顺序点入本实验室每次试验质控血清的测定值。
质控图的绘制步骤:
实验室在报告实验结果之前必须评价质控数据,可通过图形记录的检查或由计算机审核结果来决定。目前许多质控规则已被采用,常用的是12S和13S规则。
质控规则的使用应检出随机误差和系统误差,即具有高的检出分析误差的能力,同时应具有较低的假失控概率。考察试验系统的可靠性应采用多标准质控方案,多规则质控方法能提高误差检出,并具有低的假失控概率。其要点为:
出现一次2s范围的变化时,系统处于告警状态,应予注意,是否可以继续检测需要进一步观察。
出现下列情况时,应暂停检测查找原因:出现一次3s范围的变化、连续两次出现同一方向2s范围的变化、连续四次出现同一方向的1s范围的变化、连续10次结果都在1s范围内,但落在均值线的同一侧。
实验室应建立质控图分析及失控情况处理程序。
当质控已有计划并恰当地执行时,要求可靠的平均值和标准差用于计算质控限,将假失控概率降到最低。当出现失控时进行如重复质控测定或重新分析新的质控物不是最有效的方法,必须找出问题原因,找出解除故障的方法,并消除原因,防止将来出现同样的问题。
4.3 “即刻法”质控
“即刻法”质控方法是在对同一批外部质控血清连续测定3次后,即可对第3次检验结果进行质控。具体计算方法如下:

表7 SI值表
|
n |
n3s |
N2s |
n |
n3s |
n2s |
|
3 |
1.16 |
1.15 |
12 |
2.55 |
2.29 |
|
4 |
1.49 |
1.46 |
13 |
2.61 |
2.33 |
|
5 |
1.75 |
1.67 |
14 |
2.66 |
2.37 |
|
6 |
1.94 |
1.82 |
15 |
2.71 |
2.41 |
|
7 |
2.10 |
1.94 |
16 |
2.75 |
2.44 |
|
8 |
2.22 |
2.03 |
17 |
2.79 |
2.47 |
|
9 |
2.32 |
2.11 |
18 |
2.82 |
2.50 |
|
10 |
2.41 |
2.18 |
19 |
2.85 |
2.53 |
|
11 |
2.48 |
2.23 |
20 |
2.88 |
2.56 |
(1)当SI上限和SI下限
(2)当SI上限和S, I下限有一值处于n2s~n3s值之间时说明该值在2s~3s范围,处于“告警”状态。
(3)当SI上限和SI下限有一值> n3s值时说明该值已在3s范围之外,属“失控”。数值处于“告警”和“失控”状态应舍去,需重新测定该质控血清和病人样品。舍去的只是失控的这次数值,其它测定值仍可继续使用。
5 质量评价(EQA)
5.1 评价体系
5.2 实验室室间质量评价及质量考评
质量考评办法见本规范第九章
第九章 艾滋病实验室质量考评办法
1 范围
本章规定了艾滋病实验室质量考评办法,适用于全国各级各类艾滋病实验室的质量考评。
2 规范性引用文件
《全国艾滋病检测工作规范》,卫生部,1997。
NCCLS GP27-A Using Proficiency Testing(PT) to Improve the Clinical Laboratory; Approved Guideline.
NCCLS. GP 9-A Selecting and Evaluating a Referal Laboratory; Approved Guideline.
3 考评目的
3.1 评价实验室对HIV抗体筛查检测和确认的水平,为各实验室提供外部质控机制,为检查和重新认定实验室资格提供技术依据。
3.2 促进艾滋病实验室建设,通过考评使其检测技术、质量管理和人员素质得到提高。
3.3 逐步完善确认中心实验室和各级实验室的功能,使这些实验室在本省或本系统内能正确完成HIV抗体检测,并在省(自治区、直辖市)卫生厅(局)、省财政统一领导和支持下做好艾滋病确认中心实验室和各级实验室的各项职能工作。
3.4 提高实验室技术和管理水平,为国际合作项目提供高质量的技术支持,促进国际合作(项目)在中国的健康发展。
4 考评对象及组织单位
4.1 中国疾控中心委托性艾中心参比实验室负责组织对确认中心实验室和确认实验室的全面质量考评工作,全国所有经正式批准的艾滋病确认实验室为接受考评单位。
4.2 各省疾控中心艾滋病确认中心实验室负责对全省各艾滋病实验室进行室间质量考评。
4.3 实验室质量考评每年至少1次,血清学检测能力验证和职能工作考评可分别进行。各项检测指标的血清学检测能力验证可根据需要每年2~3次。
5 考评内容和方式
5.1 考评内容包括:HIV抗体筛查和确认技术、结果报告和各项职能工作的完成情况。
5.2 考评方式包括:实验操作,问卷调查和现场抽查。考核成绩由血清学检测和职能工作及现场抽查组成,以使考评反映出真实情况。
6 考评工作程序
6.1 考评之前召开艾滋病实验室审评和技术指导专家组会议,确定考评的具体实施方案、问卷调查内容及有关事宜。
6.2 考评实验室要建立考评血清盘,并经过严格检测和标定,将标定结果作为参考备案。血清盘改变时要经过艾滋病实验室审评和技术指导专家组讨论。考评血清盘可由5-10份样品组成,包括强阳性、弱阳性和阴性样品。
6.3 考评血清随机编号后,发给参评实验室,同时发放考评问卷调查表。
6.4 各参评实验室应严格按照“规范”要求,检测考评血清,填写报告单。实验原始记录应保存备案。必须根据当年实际情况逐项如实填写实验室问卷调查表。
6.5 各参评实验室将检测报告和填写完整的问卷调查表加盖公章后,按规定期限报至考评实验室。
6.6 检测结果的评判:考评实验室接到检测报告和问卷后,根据评分标准对各参评实验室的检测结果及问卷进行汇总、统计、分析和评估。必要时可调用有关实验的原始记录和免疫印迹条带进行分析核查。各参评实验室检测结果汇总后存档。
6.7 现场抽查:根据考评结果,由艾滋病实验室审评和技术指导专家组对约20%左右的参评实验室进行现场抽查。
结果判定是否正确,报告书写是否规范;加盖公章后将实验结果复印件交审评专家组,审评结束后报国家艾滋病检测参比实验室。实验原始记录及免疫印迹条带必须保存备案。
1)省内HIV实验室网络建设、技术指导和业务培训情况;
2)省内HIV实验室的质量管理和室间质量考评;
3)省内HIV临床诊断试剂质量评估;
7 考评结果的判定
7.1 判分原则
包括考评血清检测得分和各项职能工作完成情况的得分,两部分分别计算。血清检测得分包括最终结果的判定、确认试验反应带型的符合率和ELISA检测结果。
职能工作考核应根据实际情况加入量化指标。
7.2 常规评分标准
包括参评实验室考评样品检测得分,各项职能工作完成情况得分,二者满分均为100分。
7.3 考评结果的判定
表8 考评结果判定标准
|
级别 |
考评样品得分 |
职能工作得分 |
|
不及格 |
≤60分 |
≤60分 |
|
较差 |
61~70分 |
61~70分 |
|
合格 |
71~80分 |
71~80分 |
|
良好 |
81~95分 |
80分 |
|
优秀 |
>95分 |
≥91分 |
注:>92分为优秀;>80分为良好;>70分为合格。
国家艾滋病检测参比实验室根据血清考评结果、职能工作完成情况及专家组对部分实验室现场考核情况,写出本年度艾滋病检测实验室考评情况汇报,征求专家意见后,确定各参评实验室的最终评判结果,并对各类结果提出相应的处理意见和建议,上报中国CDC、卫生部疾控司审批。
8 考评结果的处理
经艾滋病实验室审评和技术指导专家组讨论后,将考评情况上报中国疾控中心批复后,将各艾滋病检测实验室的考评得分及扣分原因反馈各实验室,合格者发给合格证书。并将考评得分及扣分原因发至各参评实验室。
8.1 对考评合格实验室的资格认证和鼓励
8.2 对考评成绩较差实验室的整顿措施
8.3 各参评实验室考评资料汇总及存档
各参评实验室考评结果、成绩及有关文件、资料汇总后装订成册存档。
第十章 HIV诊断试剂临床质量评估方案
1 范围
本章规定了HIV诊断试剂临床质量评估方案,适用于全国各级各类艾滋病实验室使用的检测试剂的质量评估。
2 规范性引用文件
《全国艾滋病检测工作规范》卫生部1997。
3 评估目的
由试剂使用单位对HIV诊断试剂进行临床质量评估是对国家药品监督管理部门审评试剂生产和批批检制度的一项重要补充,也是许多国家控制市场销售的HIV诊断试剂质量的重要手段。
对国内市场销售的国产和进口的HIV诊断试剂的敏感性、特异性、批间差异和适用性进行综合质量评估,及时发现和解决试剂质量问题,为中央和地方卫生行政部门提供有关的决策依据,并作为艾滋病实验室选择试剂的依据。未参加评估的试剂一般不推荐使用。
4 评估组织及参加单位
4.1 国家级评估
国家艾滋病参比实验室(简称参比实验室)负责组织全国的HIV诊断试剂临床质量评估,选择部分具备资质的艾滋病确认中心实验室和确认实验室参与评估。每年至少组织1次,使其规范化、制度化。
4.2 省级评估
省艾滋病确认中心实验室为各省HIV诊断试剂临床评估的主要职能单位。由省艾滋病确认中心实验室组织评估本省使用的HIV诊断试剂质量,选择省内艾滋病确认实验室或具备资质的艾滋病筛查中心实验室参与评估。每年至少组织1次,使其规范化、制度化。
5 评估程序
5.1 国家级评估
应在最佳条件下进行比较实验,即在同一实验室采用统一的技术方法、仪器设备、由同一批检测人员严格按照各试剂操作要求进行评估。
5.2 省级评估
各省艾滋病确认中心实验室可根据国家级评估方案及本省具体情况制定省级评估方案。
6 评估结果的分析及统计处理
测试后的检测结果可按下列指标统计处理:
6.1 敏感性:真阳性/(真阳性+假阴性)×100%
6.2 特异性:真阴性/(真阴性+假阳性)×100%
6.3 假阳性率:假阳性/(真阴性+假阳性)×100%
6.4 假阴性率:假阴性/(真阳性+假阴性)×100%
6.5 功效率:功效率是指不产生假阳性和假阴性结果的效率,是一种将敏感性和特异性相结合的综合质量指标,其公式为:
(真阳性+真阴性)/(真阳性+假阳性+真阴性+假阴性)×100%
s
6.6 变异系数(cv):是反映各次OD值相对于均值的离散程度的指标,可以用于衡量被检测试剂的重复性或精密度。在整套质评样品中有专供测定变异系数的样品,连续测定20孔,求出
6.7 阳性预示值(PPV)和阴性预示值(NPV):这种指标还考虑到人群感染率的分布,PPV表示阳性检测结果为真阳性的概率,NPV表示阴性检测结果为真阴性的概率。它们的简单估算公式为:
PPV=真阳性/(真阳性+假阳性)×100%
NPV=真阴性/(真阴性+假阴性)×100%
7 评估结果的收集、分析、上报和反馈
7.1 所有原始记录由参评实验室存档备案。
7.2 参比实验室对所有资料进行汇总和分析。
7.3 参比实验室每年将全国HIV诊断试剂临床质量评估结果上报中国疾控中心、卫生部疾控司、医政司和国家食品药品监督管理局,并反馈给各省、自治区、直辖市卫生行政部门和艾滋病实验室,为艾滋病实验室选购试剂、为生产厂家提高试剂质量提供参考依据。
7.4 每次国家级艾滋病诊断试剂临床质量评估的主要结果将在《艾滋病预防控制信息》上予以公布。
7.5 艾滋病确认中心实验室组织的省级HIV诊断试剂临床质量评估工作,在评估后应将结果上报本省卫生行政部门和参比实验室,以便及时沟通情况,发现和解决问题。
附表1
HIV抗体筛查报告
REPORT OF HIV ANTIBODY SCREENING TESTING
秘密SECRET 编号NO.
|
送检单位 FROM |
|
送检日期 DATE |
年 月 日 YEAR MONTH DAY | ||||||||
|
送检标本 SPECIMEN |
|
送检人群 POPULATION |
| ||||||||
|
姓名 NAME |
|
性别 SEX |
|
年龄 AGE |
|
职 业 OCCUPATION |
| ||||
|
国籍或民族 NATIONALITY |
|
地址 ADDRESS |
| ||||||||
|
检测方法 METHODS |
日 期 DATE |
检测结果 RESULTS | |||||||||
|
ELISA |
|
| |||||||||
|
PA |
|
| |||||||||
|
快速 |
|
| |||||||||
|
|
|
| |||||||||
|
|
|
| |||||||||
|
结论 CONCLUSION |
| ||||||||||
|
检测者 OPERATOR |
|
签发者 HEAD |
|
报告日期 DATE |
年 月 日 YEAR MONTH DAY | ||||||
|
筛查单位或实验室(公章) INSTITUTION OR LABORATORY |
备注 NOTE | ||||||||||
中国疾病预防控制中心制订
PRINTED BY
CONTROL AND PREVENTION
附表2
HIV抗体复检化验单
秘密 , ; 编 号
|
送检单位 |
|
送检日期 |
年 月 日 | |||||||||
|
送检标本 |
|
送检人群 |
| |||||||||
|
姓名 |
|
性别 |
|
年龄 |
|
职业 |
|
| ||||
|
现住址 |
|
户籍所在地 |
|
| ||||||||
|
国籍或民族 |
|
既往病史 |
|
| ||||||||
|
初 筛 试 验 |
复 检 试 验 | |||||||||||
|
第一次 |
第二次 | |||||||||||
|
检测日期 |
|
|
| |||||||||
|
检测方法 |
|
|
| |||||||||
|
试剂厂家 |
|
|
| |||||||||
|
批 号 |
|
|
| |||||||||
|
有 效 期 |
|
|
| |||||||||
|
ELISA法 OD值 |
空 白 |
|
|
| ||||||||
|
阴性对照均值 |
|
|
| |||||||||
|
阳性对照 |
|
|
| |||||||||
|
临 界 值 |
|
|
| |||||||||
|
送检标本 |
|
|
| |||||||||
|
结 果 |
|
|
| |||||||||
|
检测者 |
审核者 | |||||||||||
|
送检单位(公章) 电话 邮编 |
备注:本表全部由送检单位填写 | |||||||||||
中国疾病预防控制中心制订
附表3
HIV抗体确认检测报告单
REPORT OF HIV ANTIBODY CONFIRMATORY TESTING
秘密SECRET 编号NO.
|
送检单位 FROM |
|
送检日期 DATE |
年 月 日 YEAR MONTH DAY | |||||||||
|
送检标本 SPECIMEN |
|
送检人群 POPULATION |
| |||||||||
|
姓名 NAME |
|
性别 SEX |
|
年龄 AGE |
|
职 业 OCCUPATION |
| |||||
|
婚姻状况 MARRIAGE WEDLOCK |
|
文化程度 EDUCATIONAL ATTAINMENTS |
| |||||||||
|
国籍或民族 NATIONALITY |
|
地址 ADDRESS |
| |||||||||
|
检测方法 METHOD |
日 期 DATE |
检测结果 RESULTS | ||||||||||
|
筛查试剂1 |
|
| ||||||||||
|
筛查试剂2 |
|
| ||||||||||
|
筛查试剂3 |
|
| ||||||||||
|
|
|
| ||||||||||
|
WB带型 |
|
| ||||||||||
|
结论 CONCLUSION |
| |||||||||||
|
检测者 OPERATOR |
|
签发者 HEAD |
|
报告日期 DATE |
年 月 日 YEAR MONTH DAY | |||||||
|
确认单位或实验室(公章) INSTITUTION OR LABORATORY |
备注 NOTE | |||||||||||
中国疾病预防控制中心制订
PRINTED BY
CONTROL AND PREVENTION
附表4
HIV感染流行病学监测疫情报告单
REPORT OF HIV SEROEPIDEMIOLOGY SURVEILLANCE
秘密SECRET 报告单编号NO. 第 页 共 页
|
送检单位 FROM |
|
送检日期 DATE |
年 月 日 YEAR MONTH DAY | |||||
|
送检标本 SPECIMEN |
|
送检人群 POPULATION |
| |||||
|
标本编号 No. |
起始号 终末号 FROM END |
标本数量 QUANTITY |
| |||||
|
采样地址 ADDRESS |
| |||||||
|
检测方法、试剂 METHOD,REAGENT |
| |||||||
|
标本编号 No. |
原送检号 No. |
检测结果 RESULTS(S/CO比值) |
疫情报告结论 CONCLUSION | |||||
|
|
|
|
| |||||
|
|
|
|
| |||||
|
|
|
|
| |||||
|
|
|
|
| |||||
|
|
|
|
| |||||
|
检测者 OPERATOR |
|
签发者 HEAD |
|
报告日期 DATE |
年 月 , 日 YEAR MONTH DAY | |||
|
检测单位或实验室(公章) INSTITUTION OR LABORATORY |
备注 NOTE 1. 本报告仅对送检样品负责,作为流行病学疫情监测结果,不作为通知个人依据,对个人资料做好严格保密! 2. 请做好检测后咨询,建议进一步做确认试验。 | |||||||
附表5
HIV抗体替代策略检测报告单
REPORT OF HIV ANTIBODY ALTERNATIVE STRATEGY TESTING
秘密SECRET 编号NO.
|
送检单位 FROM |
|
送检日期 DATE |
年 月 日 YEAR MONTH DAY | |||||||||
|
送检标本 SPECIMEN |
|
送检人群 POPULATION |
| |||||||||
|
姓名 NAME |
|
性别 SEX |
|
年龄 AGE |
|
职 业 OCCUPATION |
| |||||
|
婚姻状况 MARRIAGE WEDLOCK |
|
文化程度 EDUCATIONAL ATTAINMENTS |
| |||||||||
|
国籍或民族 NATIONALITY |
|
地址 ADDRESS |
| |||||||||
|
检测方法、试剂 METHOD,REAGENT |
日 期 DATE |
检测结果 RESULTS(S/CO比值) | ||||||||||
|
第一种筛查检测(ELISA-1) |
|
| ||||||||||
|
第二种筛查检测(ELISA-2) |
|
| ||||||||||
|
第三种筛查检测(高特异性试剂) |
|
| ||||||||||
|
|
|
| ||||||||||
|
结论 CONCLUSION |
| |||||||||||
|
检测者 OPERATOR |
|
签发者 HEAD |
|
报告日期 DATE |
年 月 日 YEAR MONTH DAY | |||||||
|
检测单位或实验室(公章) INSTITUTION OR LABORATORY |
备注 NOTE | |||||||||||
中国疾病预防控制中心制订
PRINTED BY
CONTROL AND PREVENTION
附表6
HIV抗体检测数季报表
__________年 季度
填报单位: E-mail:__________________ No.
|
人 群 分 类 |
本 季 度 |
本年度累计报告 阳性数 | ||||||
|
筛查 |
WB |
用于监测的实验室检测方法报告疫情 | ||||||
|
检测数 |
阳性数 |
检测数 |
阳性 |
不确定 |
复测数 |
阳性数 | ||
|
性病病人 |
|
|
|
|
|
|
|
|
|
暗娼、嫖客 |
|
|
|
|
|
|
|
|
|
吸毒者 |
|
|
|
|
|
|
|
|
|
有偿供血(浆)者 |
|
|
|
|
|
|
|
|
|
受血或输注血液制品者 |
|
|
|
|
|
|
|
|
|
同性恋者 |
|
|
|
|
|
|
|
|
|
HIV阳性者的配偶/性伴 |
|
|
|
|
|
|
|
|
|
临床可疑者 |
|
|
|
|
|
|
|
|
|
术前检查者 |
|
|
|
|
|
|
|
|
|
献血员 |
|
|
|
|
|
|
|
|
|
出境、入境体检者 |
|
|
|
|
|
|
|
|
|
婚检者 |
|
|
|
|
|
|
|
|
|
孕产妇 |
|
|
|
|
|
|
|
|
|
无关联、自愿检测 |
|
|
|
|
|
|
|
|
|
流动人口 |
|
|
|
|
|
|
|
|
|
其它 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
合 计 |
|
|
|
|
|
|
|
|
单位(盖章): 填表人(签字): 报告日期: 年 月 日
附表7
艾滋病职业暴露个案登记表
|
一.基本情况 |
||||||||||||||||||||||||||||||||||||||
|
编 号 |
|
性别 |
|
年龄/工龄 |
/ |
职 业 |
|
|||||||||||||||||||||||||||||||
|
工作单位 |
|
|||||||||||||||||||||||||||||||||||||
|
发生时间 |
|
发生地点 |
|
|||||||||||||||||||||||||||||||||||
|
暴露时从事何种防治活动 |
|
|||||||||||||||||||||||||||||||||||||
|
是否接受过艾滋病安全操作培训 |
| |||||||||||||||||||||||||||||||||||||
|
二.暴露方式 |
| |||||||||||||||||||||||||||||||||||||
|
(一)接触暴露 |
| |||||||||||||||||||||||||||||||||||||
|
1. 皮肤 无破损 □ 有破损 □ |
2. 粘膜 □ |
|||||||||||||||||||||||||||||||||||||
|
3. 接触部位 |
|
4. 接触面积 |
cm2 |
|||||||||||||||||||||||||||||||||||
|
5. 暴露量和时间 |
量小暴露时间短 □ |
量大暴露时间长 □ |
| |||||||||||||||||||||||||||||||||||
|
6. 污染物来源 |
(1)血液 □ |
(2)何种体液 |
(3)其它: |
|||||||||||||||||||||||||||||||||||
|
(二)针刺或锐器割伤 |
| |||||||||||||||||||||||||||||||||||||
|
1. 何种器械 |
(1)空心针 □ |
(2)实心针 □ |
(3)其它器械: |
|||||||||||||||||||||||||||||||||||
|
2. 损伤程度、危险度 |
表皮擦伤、针刺 低危 □ |
伤口较深、器皿上可见血液 高危 □ |
||||||||||||||||||||||||||||||||||||
|
3. 污染物来源 |
(1)血液 □ |
(2)含血体液: |
(3)其它: |
|||||||||||||||||||||||||||||||||||
|
(三)其它方式 |
||||||||||||||||||||||||||||||||||||||
|
致伤方式 |
抓伤 □ 咬伤 □ 其它 |
破损、出血 有□ 无□ |
||||||||||||||||||||||||||||||||||||
|
三.暴露源严重程度 |
| |||||||||||||||||||||||||||||||||||||
|
(一) 实验室标本 |
1.血液 &nbs, p; □ |
2.何种体液: |
||||||||||||||||||||||||||||||||||||
|
3.其它: |
4.病毒含量: 滴度低 滴度高 |
|||||||||||||||||||||||||||||||||||||
|
5.其它情况: |
||||||||||||||||||||||||||||||||||||||
|
(二) 来源于患者 |
患者编号 |
|
性 别 |
|
年 龄 |
|
确诊时间 |
|
||||||||||||||||||||||||||||||
|
患者病情 |
无症状HIV感染者 □ |
有症状,但不同于艾滋病 □ |
艾滋病期. □ |
|||||||||||||||||||||||||||||||||||
|
病毒载量 |
|
CD4细胞计数 |
|
|||||||||||||||||||||||||||||||||||
|
备注: |
|
| ||||||||||||||||||||||||||||||||||||
|
四.暴露后紧急处理 |
|
| ||||||||||||||||||||||||||||||||||||
|
(一)皮肤 |
1.清水冲洗 □ |
2.是否用肥皂 是□ 否□ |
|
|||||||||||||||||||||||||||||||||||
|
3.是否挤出损伤处血液: 是 □ 否 □ |
4.消毒药物: |
|
||||||||||||||||||||||||||||||||||||
|
5.冲洗时间: min |
|
|
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
(二)粘膜 |
1.生理盐水 □ |
2.清水 □ |
|
|||||||||||||||||||||||||||||||||||
|
3.其它液体: |
4.冲洗时间: min |
|
||||||||||||||||||||||||||||||||||||
|
备注: |
|
| ||||||||||||||||||||||||||||||||||||
|
五.评估 |
|
| ||||||||||||||||||||||||||||||||||||
|
(一)暴露级别 |
(1)1级暴露 □ |
(2)2级暴露 □ |
(3)3级暴露 □ |
|
||||||||||||||||||||||||||||||||||
|
(二)暴露源头严重程度 |
(1)轻度 □ |
(2)重度 □ |
(3)不明 □ |
|
||||||||||||||||||||||||||||||||||
|
|
|
评 估 人: |
|
|
| |||||||||||||||||||||||||||||||||
|
六.暴露后预防性治疗方案 |
|
| ||||||||||||||||||||||||||||||||||||
|
1.是否需要预防性用药 是□ 否□ |
|
|||||||||||||||||||||||||||||||||||||
|
2.用何种药物及用量 |
(1) |
|
||||||||||||||||||||||||||||||||||||
|
(2) |
|
|||||||||||||||||||||||||||||||||||||
|
(3) |
|
|||||||||||||||||||||||||||||||||||||
|
3.开始用药时间 |
|
4.停止用药时间 |
|
|
||||||||||||||||||||||||||||||||||
|
5.因毒副作用,修改治疗方案 |
|
|
| |||||||||||||||||||||||||||||||||||
|
6.副作用 |
|
|
| |||||||||||||||||||||||||||||||||||
|
肝功能检查 肾功能检查 |
|
|
| |||||||||||||||||||||||||||||||||||
|
七.症状 |
|
| ||||||||||||||||||||||||||||||||||||
|
暴露后4周内是否出现急性HIV感染症状 是□ 否□ |
|
|||||||||||||||||||||||||||||||||||||
|
何种症状 |
|
持续时间 |
|
|
||||||||||||||||||||||||||||||||||
|
备注: |
|
| ||||||||||||||||||||||||||||||||||||
|
八.HIV血清学检查 |
|
| ||||||||||||||||||||||||||||||||||||
|
|
项目 |
日期 |
结果 |
项目 |
日期 |
结果 |
|
|||||||||||||||||||||||||||||||
|
暴露后当天 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
4周 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
8周 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
12周 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
6个月 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
备注: |
|
|||||||||||||||||||||||||||||||||||||
|
九.结论 |
|
|||||||||||||||||||||||||||||||||||||
|
1.暴露后未感染HIV □ |
2.暴露后感染HIV □ |
|
||||||||||||||||||||||||||||||||||||
|
备注: |
|
|||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||
填表单位______________________ 填 表 人______________________
审 核 人______________________ 填表时间______________________
联系电话______________________
附表8
艾滋病防治工作人员职业暴露事故汇总表
|
编号 |
工作单位 |
发生 时间 |
发生地点 |
暴露方式及级别 |
感染源级别 |
紧急局部处理 |
处理方案 |
首次用药时间(暴露后几小时或几天) |
药物毒副作用 |
抗HIV 1/2检测结果 当天 4周 8周 12周 6月 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
填表日期: 填表单位: 填表人: 审核人:

